TERMOMETRÍA
La termometría se encarga de la medición de la temperatura de cuerpos o sistemas. Para este fin, se utiliza el termómetro, que es un instrumento que se basa en el cambio de alguna propiedad de la materia debido al efecto del calor; así se tiene el termómetro de mercurio y de alcohol, que se basan en la dilatación, los termopares que deben su funcionamiento al cambio de la conductividad eléctrica, los ópticos que detectan la variación de la intensidad del rayo emitido cuando se refleja en un cuerpo caliente.
Tomado de Wikipedia
CALORIMETRÍA
La Calorimetría es la medida de la cantidad de calor que cede o absorbe un cuerpo en el curso de un proceso físico o químico. Es la Energía Térmica que se transfiere de un objeto a otro cuando entran en contacto mutuo, debido a una diferencia de temperaturas entre ellos. La dirección de la transferencia de la Energía Térmica es siempre desde la sustancia de mayor temperatura hacia la de menor temperatura. Cuando fluye calor entre dos objetos o sustancias que se encuentran unidas; se dice que están en CONTACTO TÉRMICO.
PRINCIPIOS GENERALES DE LA CALORIMETRÍA
I. Siempre que entre varios cuerpos haya un intercambio de energía térmica, la cantidad de calor perdido por unos cuerpos es igual a la cantidad de calor ganada por los otros.
II. La cantidad de calor absorbida o desprendida por un cuerpo es directamente proporcional a su variación de temperatura. Así, para elevar la temperatura de un cuerpo de 20°C se requiere el doble de cantidad de energía térmica que para elevarla a 10°C.
III. La cantidad de calor absorbida o desprendida por un cuerpo es directamente proporcional a su masa.
IV. Cuando varios cuerpos a temperaturas diferentes se ponen en contacto, la energía térmica se desplaza hacia los cuerpos cuya temperatura es más baja. El equilibrio térmico ocurre cuando todos los cuerpos quedan a la misma temperatura.

II. La cantidad de calor absorbida o desprendida por un cuerpo es directamente proporcional a su variación de temperatura. Así, para elevar la temperatura de un cuerpo de 20°C se requiere el doble de cantidad de energía térmica que para elevarla a 10°C.
III. La cantidad de calor absorbida o desprendida por un cuerpo es directamente proporcional a su masa.
IV. Cuando varios cuerpos a temperaturas diferentes se ponen en contacto, la energía térmica se desplaza hacia los cuerpos cuya temperatura es más baja. El equilibrio térmico ocurre cuando todos los cuerpos quedan a la misma temperatura.

TEMPERATURA Y ESCALAS TERMOMÉTRICAS
La temperatura es una magnitud referida a las nociones comunes de caliente, tibio, frío que puede ser medida, específicamente, con un termómetro. En física, se define como una magnitud escalar relacionada con la energía interna de un sistema termodinámico, definida por el principio cero de la termodinámica. A medida de que sea mayor la energía cinética de un sistema, se observa que éste se encuentra más "caliente"; es decir, que su temperatura es mayor.
Tomado de Wikipedia
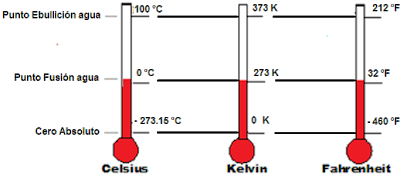
ESCALA CELSIUS O CENTÍGRADA
El científico sueco Andes Celsius (1701-1744) construyó por primera vez la escala termométrica que lleva su nombre. Eligió como puntos fijos el de fusión del hielo y el de ebullición del agua, tras advertir que las temperaturas a las que se verificaban tales cambios de estado eran constantes a la presión atmosférica. Asignó al primero el valor 0 y al segundo el valor 100, con lo cual fijó el valor del grado Celsius (°C) como la centésima parte del intervalo de temperatura comprendido entre esos dos puntos fijos.
Para esta escala, estos valores se escriben como 100 °C y 0 °C y se leen 100 grados Celsius y 0 grados Celsius, respectivamente.
ESCALA FAHRENHEIT
La escala Fahrenheit difiere de la Celsius tanto en los valores asignados a los puntos fijos, como en el tamaño de los grados. En la escala Fahrenheit los puntos fijos son los de ebullición y fusión de una disolución de cloruro amónico en agua. Así al primer punto fijo se le atribuye el valor 32 y al segundo el valor 212. Para pasar de una a otra escala es preciso emplear la ecuación:
t(°F) = (9/5) * t(°C) + 32 o t(°C) = (5/9) * [t(°F) - 32]
donde t(°F) representa la temperatura expresada en grados Fahrenheit y t(°C) la expresada en grados Celsius.
ESCALA KELVIN O ABSOLUTA
Se comparan las escalas Celsius y Kelvin mostrando los puntos de referencia anteriores a 1954 y los posteriores para mostrar cómo ambas convenciones coinciden. De color negro aparecen el punto triple del agua (0,01 °C, 273,16 K) y el cero absoluto (-273,15 °C, 0 K). De color gris los puntos de congelamiento (0,00 °C, 273,15 K) y ebullición del agua (100 °C, 373,15 K).
Si bien en la vida diaria las escalas Celsius y Fahrenheit son las más importantes, en ámbito científico se usa otra, llamada "absoluta" o Kelvin, en honor a sir Lord Kelvin.
En la escala absoluta, al 0 °C le hace corresponder 273,15 K, mientras que los 100 °C se corresponden con 373,15 K. Se ve inmediatamente que 0 K está a una temperatura que un termómetro centígrado señalará como -273,15 °C. Dicha temperatura se denomina "cero absoluto".
MECANISMOS DE TRANSFERENCIA DE CALOR
CONDUCCIÓN.
Transferencia de calor a través de un cuerpo o entre dos cuerpos en contacto, sin que se desplacen las moléculas de los mismos. Ocurre sólo en los materiales sólidos.
Transferencia de calor a través de un cuerpo o entre dos cuerpos en contacto, sin que se desplacen las moléculas de los mismos. Ocurre sólo en los materiales sólidos.
CONVECCIÓN.
Transferencia de calor entre dos partes de un cuerpo a causa del desplazamiento de sus moléculas. Ocurre sólo en los fluídos (líquidos y gases). El movimiento de las moléculas se origina por la diferencia de densidades que hay dentro de la sustancia, generando corrientes de convección desde las partes más calientes hacia las más frías en la masa del fluído.
Transferencia de calor entre dos partes de un cuerpo a causa del desplazamiento de sus moléculas. Ocurre sólo en los fluídos (líquidos y gases). El movimiento de las moléculas se origina por la diferencia de densidades que hay dentro de la sustancia, generando corrientes de convección desde las partes más calientes hacia las más frías en la masa del fluído.
RADIACIÓN.
Transferencia de calor y energía de un cuerpo llamado foco a otro cuerpo distante, a través del VACÍO, es decir, sin la presencia de algún agente material o sustancia intermedia. Esta transferencia se logra gracias a que la energía se transporta por medio de Ondas Electromagnéticas las cuales pueden propagarse por el vacío sin ningún inconveniente.


LA ENTALPIA
La Entalpía es la cantidad de energía de un sistema termodinámico que éste puede intercambiar con su entorno. Por ejemplo, en una reacción química a presión constante, el cambio de entalpía del sistema es el calor absorbido o desprendido en la reacción. En un cambio de fase, por ejemplo, de líquido a gas, el cambio de entalpía del sistema es el calor latente, en este caso el de vaporización. En un simple cambio de temperatura, el cambio de entalpía por cada grado de variación corresponde a la capacidad calorífica del sistema a presión constante. El término de entalpía fue acuñado por el físico alemán Rudolf J.E. Clausius en 1850. Matemáticamente, la entalpía H es igual a U + pV, donde U es la energía interna, p es la presión y V es el volumen. H se mide en julios.
LA ENTROPÍA
En termodinámica, la entropía (simbolizada como S) es una magnitud física que, mediante cálculo, permite determinar la parte de la energía que no puede utilizarse para producir trabajo. Es una función de estado de carácter extensivo y su valor, en un sistema aislado, crece en el transcurso de un proceso que se dé de forma natural. La entropía describe lo irreversible de los sistemas termodinámicos.
LAS REACCIONES QUÍMICAS EXOTÉRMICAS Y ENDOTÉRMICAS. LEY DE HESS
Todos los procesos químicos que ocurren en tu cuerpo o en la naturaleza llevan implícito absorción o desprendimiento de energía mediante calor. Esto se evidencia a través de la Ley de Hess, que relaciona la energía involucrada en dependencia de la cantidad de sustancia que se transforma en los procesos.
Así por ejemplo, las reacciones químicas que ocurren en tu cuerpo dependen de las cantidades de sustancias que se procesan y a su vez determinan la cantidad de energía que se consume o libera durante el proceso.
Así por ejemplo, las reacciones químicas que ocurren en tu cuerpo dependen de las cantidades de sustancias que se procesan y a su vez determinan la cantidad de energía que se consume o libera durante el proceso.
REACCIÓN EXOTÉRMICA
En el caso de una reacción exdotérmica la cantidad de energía contenida en los reactivos es menor, con respecto a la necesaria para la formación de los productos, por esta razón es necesario suministrar constantemente energía del entorno para que la reacción progrese.
REACCIÓN ENDOTÉRMICA
Cuando los cambios químicos ocurren a presión constante (presión atmosférica), la energía suministrada o liberada en forma de calor no sólo producirá un cambio en la energía interna del sistema, sino que también se empleará para realizar trabajo, de esta forma, resulta más conveniente utilizar la entalpía H, la que toma en cuenta que el destino del calor, puede ser para realizar trabajo.
MS.c. Stalina Prado Santisteban(2015)
PARA MAYOR INFORMACIÓN VISITAR:
https://sites.google.com/a/colegiocisneros.edu.co/fisica10y11/home/termodinamica/calorimetria
http://quimica.cubaeduca.cu/las-reacciones-quimicas-exotermicas-y-endotermicas-ley-de-hess
https://scholar.google.com.ec/scholar?hl=es&as_sdt=0%2C5&as_vis=1&q=termometria+del+cuerpo+humano+&btnG=
https://books.google.com.ec/books?id=DAYHXH6hPJMC&pg=PA264&lpg=PA264&dq=reaccion+endotermica+en+el+cuerpo+humano&source=bl&ots=2hJSucv1Le&sig=ACfU3U086ttC3A757zmSqbX-GaTFWm_vnQ&hl=es-419&sa=X&ved=2ahUKEwjm0ID_jN_gAhXJo1kKHW3JCwoQ6AEwEXoECAwQAQ#v=onepage&q=reaccion%20endotermica%20en%20el%20cuerpo%20humano&f=false
http://quimica.cubaeduca.cu/las-reacciones-quimicas-exotermicas-y-endotermicas-ley-de-hess
https://scholar.google.com.ec/scholar?hl=es&as_sdt=0%2C5&as_vis=1&q=termometria+del+cuerpo+humano+&btnG=
https://books.google.com.ec/books?id=DAYHXH6hPJMC&pg=PA264&lpg=PA264&dq=reaccion+endotermica+en+el+cuerpo+humano&source=bl&ots=2hJSucv1Le&sig=ACfU3U086ttC3A757zmSqbX-GaTFWm_vnQ&hl=es-419&sa=X&ved=2ahUKEwjm0ID_jN_gAhXJo1kKHW3JCwoQ6AEwEXoECAwQAQ#v=onepage&q=reaccion%20endotermica%20en%20el%20cuerpo%20humano&f=false

No hay comentarios:
Publicar un comentario